米国立アレルギー・感染症研究所(NIAID)提供
新型コロナウイルスの感染拡大が懸念される中、ワクチンや治療薬の開発・確保は急務となっています。ニュースなどでも話題になっていますが、情報は専門性が高く断片的。そこで、今回はワクチンの作用や仕組みを解説し、新型コロナのワクチンの最新開発状況を分かりやすくまとめました。
そもそもワクチンってどういうもの?
ワクチンは、私たちの身の回りにある細菌やウイルスによって引き起こされるさまざまな感染症を防ぐために有効な手段です。ワクチンを接種することで、感染症に対する抵抗力(免疫)を作り、病気を予防します。
一般的なワクチンには生ワクチン、不活化ワクチンなどの種類があります。はしか(麻疹)、風疹、水ぼうそう(水痘)などの予防接種に使われる生ワクチンは、病原体(細菌やウイルス)の毒性を弱めて病原性をなくしたものを原料としており、免疫力を高める効果が高いとされています。
インフルエンザ予防接種などの不活化ワクチンは病原体を不活化、殺菌して感染力をなくしたものを原料として作られるので、生ワクチンに比べて免疫力は弱くなります。
その他のワクチンとして近年は、メッセンジャーRNA(m-RNA)ワクチン、DNAワクチン、ウイルスベクターワクチンが開発されています。これらは病原体の遺伝子情報を用いているため、病原性がなく、安全性が高いと考えられています。
m-RNAワクチンやDNAワクチンは、投与後に細胞内で抗原(免疫を引き起こす元)となるタンパク質を作る情報を持ったワクチンです。ウイルスベクターワクチンは、病原性がない、または弱毒性のウイルスを「ベクター(運び役)」に用いた抗原遺伝子を体内に投与することで、免疫が作られるというものです。
ワクチンの開発はどのように行なう?
新しい治療薬を作るときと同じように、ワクチンでもまずは基礎研究や動物試験を行ない、さらに人間を対象とした臨床試験(治験)を実施した上で、国の承認を得て国民に使用することができるようになります。
一般的にワクチンの治験では、同意を得た健康な希望者で安全性を確認する「第1相試験」、同意を得た少数の希望者で使用量や使用法、免疫反応を調べる「第2相試験」、同意を得た多数の希望者で有効性を調べる「第3相試験」が行なわれます。
新型コロナウイルス感染症のワクチンの治験では、第1相試験・第2相試験で少数の希望者に投与し、主に抗体ができるかどうかや副反応について調べられます。第3相試験では、ワクチンを投与した群と投与していない群との間で、その後新型コロナウイルス感染症を発症する人の割合に差があるかどうかの検証が行なわれています。
ワクチン開発の基本的な流れ
ワクチンの開発には通常10~15年ほどかかるとされています
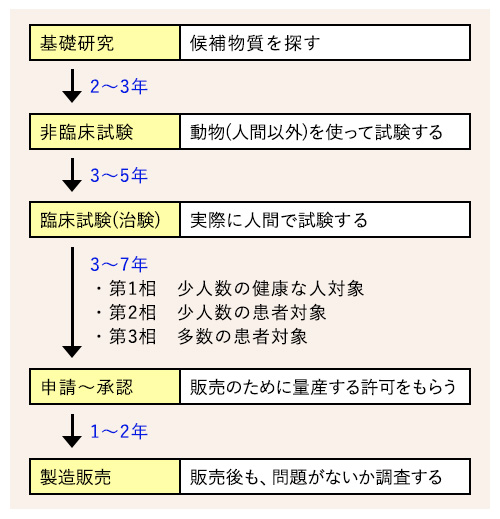
現在各国で急ピッチで進む新型コロナのワクチン開発では、遺伝情報を用いる新しいタイプ(m-RNAワクチン、DNAワクチン、ウイルスベクターワクチン)が主となっています。これらは病原性のあるウイルスそのものは使わずに開発できるため、ウイルス専用の設備が必要なく、さらに臨床試験を始めるまでの期間が大幅に短縮できるといった「開発のスピード」が利点として挙げられます。
また、欧米中心に感染症やがんワクチンなどの開発でm-RNAを使った研究が進んでいた経緯があり、その技術を新型コロナワクチンにすぐに応用できたことも短期間での開発につながっていると考えられます。一方、これまでに実用化された例がなく、有効性や安全性などについては不明な点が多いという懸念もあります。
ワクチンは副反応(副作用)がこわい?
治療薬と同様に、ワクチンにも副反応(副作用)が起こることがあります。主に接種部位の痛みや腫れなどの症状です。きわめてまれですが、特殊な健康被害が報告されることもあります。
ファイザー社の新型コロナウイルスワクチンについての2020年9月の報道では、治験の途中経過において、接種部位の痛みのほかに頭痛、倦怠感、筋肉痛などの副反応の報告があったとされています。今後、多くの人に接種した場合にどのような副反応が起こるかは未知数であるため、継続的に注視していく必要があります。
そのほか、ジョンソン・エンド・ジョンソン社、アストラゼネカ社など、新型コロナワクチンの開発を行なう製薬会社の「治験中断」のニュースがたびたび報道されています。被験薬との因果関係が否定できないまれな副反応がみられたとき、有効性の評価が難しいときなどには、治験をいったん中止して検証し、場合によっては開発自体を取りやめることもあります。このようなケースは、ワクチン開発においては珍しいことではありません。
現在までに発表されている開発中のワクチンに関する情報は、人数が限られ、観察期間が短い治験での暫定の結果です。長期的な有効性や有効期間、副反応の検証は、今後も継続しなければなりません。
また、どんなワクチンも健康な多数の人が接種することになるため、ワクチンが承認され使用が始まった後も、安全性の検証を継続的に実施することが必要です。
現在の新型コロナワクチン開発状況は?
通常、ワクチン開発の過程で有効性、安全性を十分に検証するためには約10~15年の期間が必要と考えられています。しかし、今回の新型コロナの世界的感染拡大によってワクチン開発は急ピッチで進められており、厚生労働省もできるだけ早期にワクチンを実用化したいとコメントを出しています。
世界保健機関(WHO)のまとめによると、2020年12月8日現在、全世界で臨床試験を開始しているワクチン候補は、52種類(臨床試験の前の段階のものは162種類)。
開発が進む主なワクチンとしては、以下の表の3つが挙げられます。また、国内では塩野義製薬・UMNファーマの遺伝子組み換えワクチン、第一三共・東京大学医科学研究所のm-RNAワクチン、アンジェス・大阪大学/タカラバイオのDNAワクチンなどの開発が進行しています。
開発が進む主な3つの新型コロナワクチン
| 国名 | 開発企業・ 研究施設 |
種類 (ワクチン名) |
開発段階 | 開発状況 ※2020年12月11日現在 |
|---|---|---|---|---|
| 米国 | ファイザー/ビオンテック(独) | m-RNA (BNT162b2) |
第3相 | 治験結果として95%の有効性を発表。2020年11月20日に米国食品医薬品局(FDA)に緊急使用許可を申請、11月30日に欧州医薬品庁(EMA)に条件付き販売許可を申請。英国にて12月2日に緊急使用を承認、12月 |
| 米国 | モデルナ/米国立アレルギー感染症研究所 | m-RNA (m-RNA-1273) |
第3相 | 治験結果として94.5%の有効性を発表。2020年11月30日にFDAに緊急使用許可を申請、EMAに申請。 |
| 英国 | アストラゼネカ/オックスフォード大学 | ウイルスベクター (AZD1222) |
第3相 | 2020年9月に被験者1人に原因不明の疾患が出たとして治験を中断、10月に再開。2020年11月23日に治験の暫定結果として平均で70%の有効性を発表。一部データについて信頼性を疑問視する指摘があり、追加で臨床試験を行なう方針。 |
*ワクチンの有効性について:一般的にワクチンの有効性は、ワクチンを接種した群としなかった群(偽薬を接種した群)とで発症した被験者数を比べ、「ワクチンを接種したことでその病気になるリスクを減らせた割合(有効率)」によって判断しています。ただし、新型コロナ感染症は無症候の感染者が多いため、治験の短期間での結果では判断しにくいという課題があります。
英国では、EUの欧州医薬品庁(EMA)の承認を待たずに国内の独自審査によって判断できる特別ルールによって、12月2日にファイザー社開発のワクチンの緊急使用が承認されました。そして12月8日より、80歳以上の
なお、ファイザー社のm-RNAワクチンは、その有効性を保つのに-70℃という超低温での保存・管理が必要なことが課題です。今後、冷凍庫や保冷ボックスの確保など、各国での供給体制の整備が重要となるでしょう。
日本でのワクチン供給体制は?
日本政府は、開発が先行する海外のワクチンが実用化された際には、国内で供給できるように製薬企業等と協議を進めています。現在、米国ファイザー社、モデルナ社、英国アストラゼネカ社については、協議や合意が公表されています。
ファイザー社とは2021年6月末までに6000万人のワクチン供給、モデルナ社とは2021年3月末までに2500万人のワクチン供給、アストラゼネカ社とは2021年初頭から1億2000万回分(6000万人)のワクチン供給などを、開発に成功した場合に受けることで基本的な合意を得ています。
また、米国のノババックス社と武田薬品工業が提携して国内生産を目指すことが公表されています。
日本ではいつからワクチンが使えるようになる?
現時点では、上記の3つの海外のワクチンの国内での接種がいつ開始されるかは決まっていません。海外での治験結果に加え、日本人を対象に行なった国内での治験結果を踏まえて承認が申請され、審査で有効性と安全性が認められることが必要です。
日本と同レベルでの審査がされている国で承認済のワクチンの場合、承認までの審査を簡略化して時間を短縮する「特例承認」の制度の活用も考えられます。
しかし、ワクチンは多数の健康な人に接種するという特性上、安全性が二の次となることは許されません。治療薬よりもさらに慎重に審査することが求められます。
いずれにしても、新型コロナのワクチンの動向については過度に反応せず冷静に捉え、基本的な感染予防対策をしっかりと継続することが大切です。
新型コロナ以外の病気の治療や予防も重要です。感染への恐れから医療機関への足が遠のく「受診控え」は健康を損なう原因にもなります。また、子どもの定期の予防接種の接種率が低下しているという調査結果もあります。通常のワクチン接種はきちんと行なうようにしましょう。
参考資料:
厚生労働省:新型コロナウイルス感染症のワクチンについて
https://www.mhlw.go.jp/stf/seisakunitsuite/bunya/vaccine_00184.html
日本感染症学会
http://www.kansensho.or.jp/
日本製薬工業協会(製薬協)
http://www.jpma.or.jp/
VPD(ワクチンで防げる病気)
https://www.know-vpd.jp/

PROFILE
植松 和子
済生会本部 特別参与(薬務担当)
日本赤十字看護大学大学院 非常勤講師
1974年 明治薬科大学薬学部卒業
1974年 日本赤十字社医療センター 薬剤部 入職
2013年 日本赤十字社医療センター 薬剤部 部長
2014年 慶應義塾大学薬学部大学院薬学研究科博士課程修了(薬学博士)
2016年 社会福祉法人済生会 特別参与(薬務)、共同治験事務局長
認定:小児薬物療法認定薬剤師、妊婦・授乳婦専門薬剤師、糖尿病療養指導士
専門分野:妊娠期・授乳期薬物療法、女性のライフステージと薬物療法
※所属・役職は本ページ公開当時のものです。異動等により変わる場合もありますので、ご了承ください。
※診断・治療を必要とする方は最寄りの医療機関やかかりつけ医にご相談ください。
関連記事
 免疫力低下のリスクも? 「低体温」にご注意!(病気解説特集 | 2021.1.28)
免疫力低下のリスクも? 「低体温」にご注意!(病気解説特集 | 2021.1.28) 感染拡大の今だから知りたい! ②新型コロナに特効薬はある?(緊急特集 新型コロナ 生活の中で今、本当に知りたいこと | 2021.1.15)
感染拡大の今だから知りたい! ②新型コロナに特効薬はある?(緊急特集 新型コロナ 生活の中で今、本当に知りたいこと | 2021.1.15) 新規感染者数や検査陽性率などの感染の指標から何が分かる?(緊急特集 新型コロナ 生活の中で今、本当に知りたいこと | 2020.10.19)
新規感染者数や検査陽性率などの感染の指標から何が分かる?(緊急特集 新型コロナ 生活の中で今、本当に知りたいこと | 2020.10.19) PCR検査・抗原検査・抗体検査の違いとは?(緊急特集 新型コロナ 生活の中で今、本当に知りたいこと | 2020.9.14)
PCR検査・抗原検査・抗体検査の違いとは?(緊急特集 新型コロナ 生活の中で今、本当に知りたいこと | 2020.9.14) ウイルスに効く薬をつくるのはなぜ難しい?(緊急特集 新型コロナ 生活の中で今、本当に知りたいこと | 2020.7.31)
ウイルスに効く薬をつくるのはなぜ難しい?(緊急特集 新型コロナ 生活の中で今、本当に知りたいこと | 2020.7.31) 実効再生産数ってなに?(緊急特集 新型コロナ 生活の中で今、本当に知りたいこと | 2020.7.17)
実効再生産数ってなに?(緊急特集 新型コロナ 生活の中で今、本当に知りたいこと | 2020.7.17) 感染するとどうして体調が悪くなるの?(緊急特集 新型コロナ 生活の中で今、本当に知りたいこと | 2020.6.5)
感染するとどうして体調が悪くなるの?(緊急特集 新型コロナ 生活の中で今、本当に知りたいこと | 2020.6.5) コロナってどんなウイルス?(緊急特集 新型コロナ 生活の中で今、本当に知りたいこと | 2020.6.3)
コロナってどんなウイルス?(緊急特集 新型コロナ 生活の中で今、本当に知りたいこと | 2020.6.3)


 済生会の理念
済生会の理念 施設と拠点
施設と拠点 症状別病気解説
症状別病気解説 お知らせ
お知らせ
 採用情報
採用情報 トピックス
トピックス














